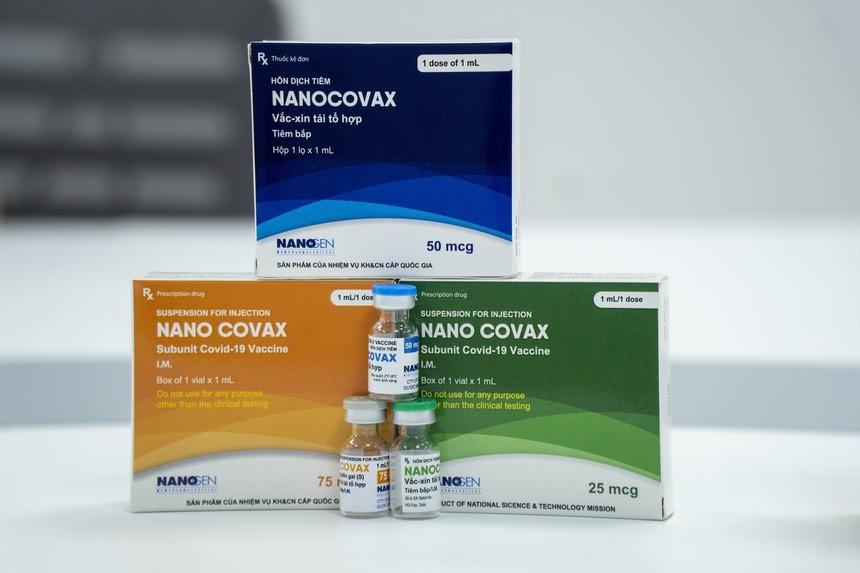
Theo đó, Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Hội đồng Cấp phép) gồm hơn 10 thành viên. Chủ tịch hội đồng là PGS.TS Lê Văn Truyền, nguyên Thứ trưởng Bộ Y tế. Ngày 29/8, Hội đồng này sẽ làm việc độc lập để xem xét, đánh giá toàn bộ hồ sơ xin cấp phép khẩn cấp của 2 loại vaccine. Đó là Nano Covax của công ty Nanogen và vaccine Hayat-Vax sản xuất tại UAE, hợp tác, chuyển giao công nghệ từ Sinopharm của Trung Quốc.
Cuộc họp thẩm định có thể gói gọn trong một ngày hoặc kéo dài hơn cho đến khi các thành viên thống nhất được kết luận cuối cùng.
Được biết, trong các ngày 20-22/8, Hội đồng Đạo đức trong nghiên cứu y sinh Quốc gia (Hội đồng Đạo đức) đã chấp thuận kết quả giữa kỳ pha 3a vaccine Nano Covax, sau đó tư vấn, chuyển hồ sơ sang Hội đồng Cấp phép để xem xét.
Nếu được cấp phép, Nano Covax có thể sản xuất ngay 8-10 triệu liều/tháng và có thể nâng cấp lên 20-25 triệu liều/tháng. Giá nhà sản xuất cung cấp là 120.000 đồng/liều sau khi được trợ giá.
Theo Thông tư 11 Hướng dẫn đăng ký lưu hành vaccine phòng Covid-19 trong trường hợp cấp bách vừa được Bộ Y tế ban hành ngày 19/8, vaccine đủ tiêu chuẩn cấp phép khẩn cấp có điều kiện khi đang thử nghiệm lâm sàng và đã có kết quả giữa kỳ pha 3 về tính an toàn và hiệu quả bảo vệ của vaccine dựa trên dữ liệu về tính sinh miễn dịch của vaccine.Theo GS Trương Việt Dũng, Chủ tịch Hội đồng Đạo đức, việc cấp phép hay không phụ thuộc hoàn toàn vào quyết định của Hội đồng Cấp phép. Hội đồng Đạo đức chỉ là bên đưa ra ý kiến tư vấn.
Việc cấp phép sẽ dựa trên ý kiến tư vấn của Hội đồng Đạo đức trong nghiên cứu y sinh học cấp Quốc gia và ý kiến tư vấn của Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, có tham khảo hướng dẫn hoặc khuyến cáo của Tổ chức Y tế thế giới (WHO).
Trong thời hạn tối đa 20 ngày làm việc kể từ ngày nhận đủ hồ sơ đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine, Cục trưởng Cục Quản lý Dược sẽ cấp giấy đăng ký lưu hành vaccine.
Vaccine Nano Covax sử dụng công nghệ protein tái tổ hợp, là vaccine đầu tiên của Việt Nam thử nghiệm lâm sàng đến pha 3. Đến nay, vaccine đã tiêm thử nghiệm gần 14.000 người, giai đoạn 3b đang tiếp tục được đánh giá.
Trước đó, công ty Nanogen và nhóm nghiên cứu đã nhiều lần đề nghị xin cấp phép khẩn cấp có điều kiện cho vaccine Nano Covax. Với quan điểm chặt chẽ, khoa học, đặt tính mạng, sức khoẻ người dân lên hàng đầu, Bộ Y tế yêu cầu nhà sản xuất hoàn thiện bộ dữ liệu để các hội đồng chuyên môn đánh giá.
Trước đó, nhiều tỉnh cũng xin được tiêm thử nghiệm vaccine Nano Covax diện rộng trong bối cảnh số ca mắc Covid-19 tăng nhanh, tuy nhiên Bộ Y tế chưa đồng ý.